LÀM THẾ NÀO ĐỂ THIẾT KẾ MỘT PHÒNG THÍ NGHIỆM REAL-TIME PCR
Như đã đề cập ở bài viết trước, độ nhạy cao của kỹ thuật real-time PCR là một trong số những vấn đề đáng lưu ý, nếu không kiểm soát tốt thì có thể dẫn đến vấn đề ngoại nhiễm DNA/RNA, gây ra những sai lầm trong việc đánh giá kết quả thí nghiệm, hay còn được biết đến là hiện tượng dương tính giả. Do đó, việc phân chia khu vực làm việc trong phòng thí nghiệm là một yếu tố vô cùng cần thiết để phòng tránh vấn đề này. Thông qua bài viết dưới đây, chúng tôi sẽ cung cấp một số kiến thức cơ bản để giúp các bạn giải quyết câu hỏi “Làm thế nào để thiết kế một phòng thí nghiệm real-time PCR?”
Bố trí khu vực làm việc
Một phòng thí nghiệm PCR đạt chuẩn cần phải đảm bảo ít nhất 3 khu vực sau:
- Khu vực pha hóa chất và master mix (sử dụng áp suất dương để ngăn ngừa ngoại nhiễm)
- Khu vực chuẩn bị mẫu (sử dụng áp suất âm để giữ DNA/RNA trong phòng)
- Khu vực khuếch đại và phát hiện sản phẩm (sử dụng áp suất âm để giữ sản phẩm khuếch đại trong phòng)
Hệ thống điều hòa không khí cho 3 khu vực cần được kết nối với các ống dẫn khí riêng biệt và mỗi ống cũng phải dẫn đến một vị trí xả khí riêng. Không sử dụng hệ thống điều hòa trung tâm cho 3 khu vực.
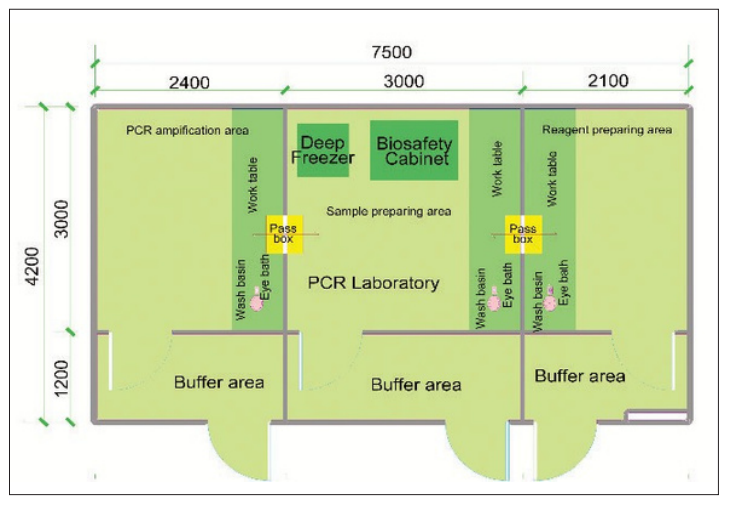
Hình 1. Sơ đồ mô tả phòng thí nghiệm PCR
Khu vực pha hóa chất và master mix
Đây là phòng sạch nhất trong 3 khu vực đã đề cập ở phía trên.
Một khu vực pha hóa chất và master mix lý tưởng cần có tủ an toàn sinh học cần có:
Đèn UV; các thuốc thử PCR nên được bảo quản trong tủ lạnh (theo khuyến cáo của nhà sản xuất có thể là tủ mát (2-8oC) hoặc tủ âm (-20oC)), tốt nhất là đặt bên cạnh tủ an toàn sinh học.
Ngoài ra, cũng nên trang bị thêm bồn rửa; các tủ chứa vật tư tiêu hao; micropipette, đầu tip có màng lọ và PPE (quần áo bảo hộ, găng tay dùng một lần,..). Ở phòng sạch, master mix sẽ được chuẩn bị và chia nhỏ vào các ống phản ứng. Lưu ý rằng việc đem các sản phẩm thu nhận được sau quá trình tách chiết acid nucleic hay khuếch đại vào khu vực này là một điều cấm kỵ.
Khu vực chuẩn bị mẫu
Khu vực được thiết kế chuyên dùng để xử lý mẫu sau đó tiến hành tách chiết và thu nhận acid nucleic, cuối cùng là thêm mẫu vào hỗn hợp PCR mix.
Quá trình bổ sung mẫu nên được thực hiện trong tủ thao tác có trang bị đèn UV. Để tránh ngoại nhiễm DNA/RNA giữa các mẫu với nhau, nên bổ sung thêm các đối chứng (chứng âm, chứng dương)
Trong quá trình đặt phản ứng, lần lượt theo thứ tự như sau:
Mẫu → Chứng âm → Chứng dương (hoặc chất chuẩn – standard).
Các mẫu phải được bảo quản trong tủ lạnh/tủ đông và thuốc thử PCR hoặc sản phẩm khuếch đại không được phép đem vào khu vực này.
Khu vực khuếch đại và phát hiện sản phẩm
Khu vực được sử dụng để thực hiện phản ứng khuếch đại PCR và phân tích kết quả sau PCR. Máy real-time PCR nên được đặt trong phòng này. Tuyệt đối không mở nắp tube chứa sản phẩm PCR khi không cần thiết, trong trường hợp, cần mở nắp tube để lấy mẫu phụ vụ cho các thí nghiệm tiếp theo thì nên trang bị thêm tủ thao tác có trang bị đèn UV.
-
Quy tắc làm việc một chiều
Quy trình real-time PCR được thực hiện lần lượt theo thứ tự như sau:
Khu vực chuẩn bị hóa chất và master mix → Khu vực chuẩn bị mẫu → Khu vực khuếch đại và phát hiện sản phẩm.
Lưu ý: Không được phép đưa các sản phẩm đã được xử lý ở khu vực này quay trở lại khu vực làm việc trước đó. Kỹ thuật viên đã làm việc ở khu vực “hậu PCR” không nên quay lại và làm việc trong khu vực “tiền PCR”.
Ngoài ra, các vật tư tiêu hao và PPE (quần áo bảo hộ, găng tay sử dụng một lần, kính bảo hộ,...) đã được đưa vào khu vực “hậu PCR” không bao giờ được đặt trở lại khu vực “tiền PCR” mà không được khử nhiễm kỹ lưỡng. Các vật liệu phế thải có chứa sản phẩm PCR không được phép đặt gần khu vực liên quan đến việc phân lập và tinh chế mẫu.
-
Thiết bị chuyên dụng và vật tư tiêu hao
Ngoài tách biệt về mặt không gian, tất cả các vật tư và thiết bị như , máy tách chiết, máy ly tâm, tủ đông/tủ lạnh bảo quản, pipet, thuốc thử, đầu tip của pipet, giá đỡ,… phải được sử dụng riêng cho từng khu vực và không được thay thế lẫn nhau giữa các khu vực. Ngoài ra, áo khoác phòng thí nghiệm cho kỹ thuật viên cũng phải được trang bị riêng cho từng khu vực.
TBR đơn vị thiết kế thi công phòng thí nghiệm PCR/Realtime PCR
Chúng tôi, TBR là đơn vị chuyên thiết kế thi công phòng thí nghiệm, xây dựng phòng sinh học phân tử đạt chuẩn theo nhu cầu của khách hàng. Chúng tôi có kinh nghiệm trong lĩnh vực sinh học phân tử, sẵn sàng khảo sát, tư vấn miễn phí cách thiết kế một phòng sinh học phân tử, đưa ra những bản vẽ 3D về thiết kế phòng cho từng khách hàng.
TBR cung cấp một giải pháp tổng thể xét nghiệm sinh học phân tử trên nhiều mảng đối tượng khác nhau: Y tế, nghiên cứu, thực phẩm, thú y, thủy sản… Chúng tôi, luôn trên tinh thần sẵn sàng hỗ trợ, tư vấn cho mọi nhu cầu của Khách hàng.
 Mọi chi tiết xin liên hệ công ty TBR:
Mọi chi tiết xin liên hệ công ty TBR: +84 28 6676 7762
+84 28 6676 7762 sales@tbr.vn
sales@tbr.vn Số 51 đường 26 - Bình trị Đông B- Bình Tân- Thành phố Hồ Chí Minh
Số 51 đường 26 - Bình trị Đông B- Bình Tân- Thành phố Hồ Chí MinhTài liệu tham khảo
-
“Establishment of PCR laboratory in developing countries 2nd version." N.p, n.d. 2016
-
Dos and Don’ts for molecular testing. https://www.who.int/teams/global-malaria-programme/case-anagement/diagnosis/nucleic-acid-amplification-based-diagnostics/dos-and-don-ts-for-molecular-testing
-
Mifflin TE. Setting up a PCR laboratory. CSH Protoc. 2007 Jul 1; 2007: pdb. top14. doi: 10.1101/pdb. top 14. PMID: 21357132.
-
Ausubel FM. The polymerase chain reaction. In: Ausubel F, Brent R, Moore D, Seidman JG, Smith J, Struhl K, editors. Current Protocols in Molecular Biology, John Wiley & Sons, Inc., U.S.A., Vol. 2, Chapter 15, 1999; 15.01
-
Aslanzadeh J (2004) Preventing PCR amplification carryover contamination in a clinical laboratory. Ann Clin Lab Sci 34(4):389–96





